Latest Galary
अमोनिया एक रसायन
| Property | Value | |||||
|---|---|---|---|---|---|---|
| मोलर द्रव्यमान | 17.031 g/मोल | |||||
| अवस्था | रंग हीन तीव्र दुर्गन्ध युक्त गैस | |||||
| घनत्व | 0.86 kg/m3 (1.013 बार क्वथनाँक पर) 0.73 kg/m3 (1.013 बार at 15 °C) 681.9 kg/m3 at −33.3 °C (द्रव) 820 kg/m3 at -80 °C (ठोस क्रिस्टल) 817 kg/m3 at -80 °C (पारदर्शी ठोस) |
|||||
| गलनाँक | −77.73 °C (195.42 K) | |||||
| क्वथनाँक | −33.34 °C (239.81 K) | |||||
| जल मे विलेयता | 1176 ग्राम/लीटर (0 °C) 702 ग्राम/लीटर (20 °C) 88 ग्राम/लीटर (100 °C) |
|||||
| अम्लता (pKa) | 9.245 | |||||
| क्षारकता (pKb) | 4.75 | |||||
| क्रान्तिक ताप | 132.4 0C | |||||
| क्रान्तिक दाब | 112.बार / 1636पीएसआई / 115 kg | |||||
अमोनिया एक रंगहीन तथा तीव्र दुर्गंन्ध वाली गैस हैl यह हवा से हल्की होती है तथा इसका घनत्व हवा का 0.589 भाग होता है। यह आसानी से द्रवित हो जाती है क्योंकि इसके अणुओ के मध्य दृढ हाइद्रोजन बंध होता है। इसकी वाष्पीकरण ऊष्मा बहुत अधिक है (23.35 kJ/मोल)
यह जल मे अति विलेय है, इसके जलीय विलयन को गरम करने से अमोनिया निकल जाती है। अमोनिया का जलीय विलयन क्षारीय होता है।. अमोनिया के अधिकतम सांद्रता के विलयन का घनत्व 0.880 ग्राम/सेमी3 है तथा इसको अक्सर ‘.880 अमोनिया' कहते हैं। यह सामान्यतः ज्वलनशील नही होती है, तथा हवा के साथ इसका दहन मिश्रण 15-25% होता है। शुद्ध आक्सीजन के साथ यह पीली लौ के साथ जलती है। उच्च ताप तथा उचित उत्प्रेरक की उपस्थिति मे यह अपने अवयवो मे अपघटित हो जाती है। अमोनिया मे क्लोरीन पास करने पर दहन की क्रिया होती है तथा हाइड्रोजन क्लोराइड बनती है, तथा यदि अमोनिया अधिकता मे है तो तीव्र विस्फोटक नाइट्रोजन ट्राईक्लोराइड (NCl3) बनता है।
भौतिक गुण
- अमोनिया गलनांक : -78oC
- अमोनिया क्वथनांक (1.013 bar) : -33.5oC
- अमोनिया गलन की गुप्त ऊष्मा (1.013 bar at boiling point) : 331.37 kJ/kg
- अमोनिया द्रव घनत्व (1.013 bar at boiling point) : 682 kg/m3 (250 K : 669 kg/m3) (300 K : 600 kg/m3) (400 K : 346 kg/m3)
- अमोनिया द्रव गत्यात्मक श्यानता (250K : 245 106 Ns/m2) (300K : 141 106 Ns/m2) (400K : 38 106 Ns/m2)
- अमोनिया द्रव ताप चालकता(250 K : 592 106 kW/m.K) (300 K : 477 106 kW/m.K) (400 K : 207 106 kW/m.K)
- अमोनिया वाष्पन की गुप्त ऊष्मा (1.013 bar at boiling point) : 1371.2 kJ/kg
- अमोनिया वाष्प दाब (at 21oC or 70oF) : 8.88 bar
- अमोनिया क्रान्तिक ताप: 132.4oC
- अमोनिया क्रान्तिक दाब: 112.8 bar
- अमोनिया गैस घनत्व (1.013 bar at boiling point) : 0.86 kg/m3
- अमोनिया गैस घनत्व (1.013 bar and 15oC (59oF)) : 0.73 kg/m33
- अमोनिया गैस दाब गुणांक (Z)
वास्तविक गैस के आयतन तथा आदर्श गैस के आयतन का अनुपात (1.013 bar and 15oC (59oF)) : 0.9929 - अमोनिया गैस विशिष्ठ भार (air = 1) (1.013 bar and 21oC (70oF)) : 0.597
- अमोनिया गैस विशिष्ठ आयतन (1.013 bar and 21oC (70oF)) : 1.411 m3/kg
- अमोनिया अमोनिया नियत दाब पर विशिष्ठ उष्मा (cp) (1.013 bar and 153C (59oF)) : 0.037 kJ/(mol.K)
- अमोनिया नियत आयतन पर विशिष्ठ उष्मा (cv) (1.013 bar and 15oC (59oF)) : 0.028 kJ/(mol.K)
- अमोनिया गैस विशिष्ठ ऊष्मा अनुपात (Gamma: cp/cv) (1.013 bar and 15oC (59oF)) : 1.309623
- अमोनिया Gas डाइनेमिक श्यानता (1.013 bar and 0oC (32oF)) : 0.000098 Poise
- अमोनिया गैस ऊष्मीय चालकता (1.013 bar and 0oC (32oF)) : 22.19 mW/(m.K)
- अमोनिया जल मे विलेयता (1.013 bar and 0oC (32oF)) : 862 vol/ vol
- अमोनिया गैस आटो इग्निशन ताप : 651oC
अमोनिया दाब एवं ताप ग्राफ़
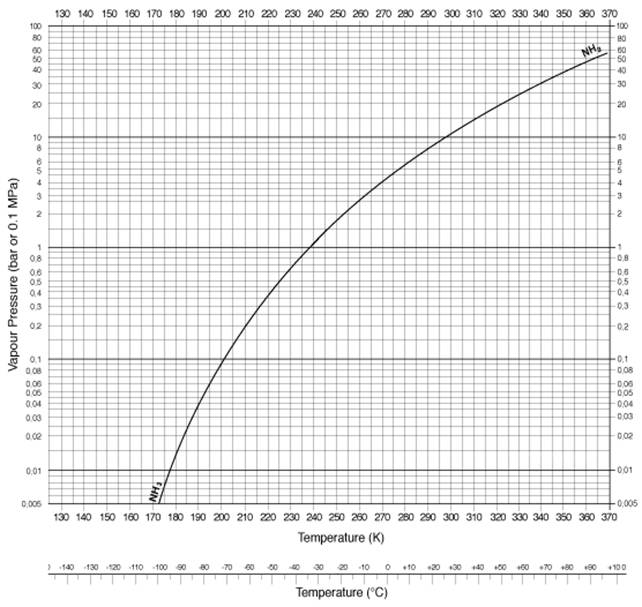
| ताप केल्विन | ताप सेल्सियस | दाब (बार) | दाब (पीएसआई) |
|---|---|---|---|
| 290 | 17 | 8 | 116 |
| 300 | 27 | 10.1 | 146 |
| 310 | 37 | 15 | 217 |
| 320 | 47 | 18.7 | 271.2 |
| 330 | 57 | 24 | 348 |
| 340 | 67 | 30 | 435 |
| 350 | 77 | 37 | 536.6 |
| 360 | 87 | 47 | 681.6 |
| 370 | 97 | 59 | 855.7 |
रासायनिक गुण (अभिक्रिया शीलता एवं संक्षारक गुण)
- हवा/ आक्सीजन के साथ क्रिया: नाइट्रोजन व जल बनते हैं तथा उर्जा प्राप्त होती है ।
4NH3 + 3 O2 ➝ 2N2 + 6 H2 O - सामान्य धातुयें शुष्क अमोनिया से प्रभावित नही होती हैं। नम अमोनिया से भी स्टील व लौह धातुओं का संक्षारण नही होता किन्तु तांबा, पीतल, तथा जिंक तथा कई अन्य विशेषत: तांबायुक्त मिश्रधातुओं का इससे संक्षारण हो जाता है। केवल स्टील तथा नर्म लोहे का इसके साथ प्रयोग उचित है।
- सामान्य परिस्थितियों मे अमोनिया बहुत स्थाई यौगिक है। सामान्य दाब पर बहुत अधिक ताप (840° to 930°F) पर यह थोडा सा अपघटित होती है तथा नाइट्रोजन तथा हाइड्रोजन प्राप्त होते है।
- इसकी प्रकृति विषैली होती है, इसके प्रभाव से नम त्वचा, नाक तथा आँखो मे जलन उत्पन्न होती है, तथा यदि अधिक तथा सांद्र मात्रा मे शूंघ ली जाय तो स्वास्थ्य के लिये हानिकारक सावित हो सकती है। हवा मे इसकी उपस्थिति का पता हमे 5 पी पी एम मात्रा मे चल जाता है। इसकी 5000 पी पी एम मात्रा हानि कारक हो सकती है तथा 10000 पीपीएम मत्रा खतरनाक हो सकती है।
क्षारकता
यह अमोनिया का एक विषेश गुण है, यह अम्लो के साथ अभिक्रिया करके अमोनियम लवण बनाती है जैसे अमोनियम क्लोराइड, अमोनियम नाइट्रेट आदि। वैसे शुष्क अमोनिया शुष्क हाइड्रोक्लोरिक अम्ल से क्रिया नही करती इसके लिये नमी की आवश्यकता पडती है।
NH3 + HCl → NH4Cl
अम्लता
यद्यपि अमोनिया क्षारीय यौगिक के रूप मे जानी जाती है, परन्तु यह एक दुर्बल क्षार की भांति भी व्यवहार करती है। यह एक प्रोटिक पदार्थ है और एमाईड बना सकता है जिसमे( NH2−) आयनहोते हैं। जैसे लीथियम के साथ अमोनिया लीथियम एमाइड बनाती है:
2 Li + 2 NH3 → 2 LiNH2+ H2
स्व-अपघटन
जल की तरह अमोनिया उभयधर्मी है तथा यह स्वयं के साथ क्रिया करके संयुग्मी अम्ल व क्षार बनाती है:
2 NH3 (l) ![]() NH+4 (जलीय) + NH−2 (जलीय)
NH+4 (जलीय) + NH−2 (जलीय)
दहन
इसके दहन से नाइट्रोजन व जल वाष्प बनते हैं तथा ऊर्जा प्राप्त होती है।
4 NH3 + 3 O2 → 2 N2 + 6 H2O (g) (ΔHºr = –1267.20 kJ/mol)
संसूचन तथा विनिश्चय
अमोनिया तथा अमोनियम लवण का बहुत अल्प मात्रा मे भी नेसलर विलयन के प्रयोग से आसानी से पता लगाया जा सकता है। जो कि एक विलक्षण पीला रंग अमोनिया तथा अमोनियम लवण की बहुत अल्प मात्रा मे भी देता है। तथा 5 पी पी एम तक का पता हमको अपनी घ्राणेन्द्रियों द्वारा भी लग जाता है।








